Oxyde de diméthylphosphine
| Oxyde de diméthylphosphine | |
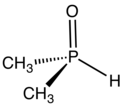
| |
| Structure de l'oxyde de diméthylphosphine | |
| Identification | |
|---|---|
| Nom UICPA | méthylphosphonoylméthane |
| No CAS | |
| No ECHA | 100.027.811 |
| No CE | 230-591-2 |
| PubChem | 81631 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C2H7OP |
| Masse molaire[1] | 78,050 1 ± 0,002 4 g/mol C 30,78 %, H 9,04 %, O 20,5 %, P 39,68 %, |
| Précautions | |
| SGH[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'oxyde de diméthylphosphine est un composé organophosphoré de formule chimique (CH3)2P(O)H. Il se présente comme un liquide incolore irritant et inflammable soluble dans les solvants polaires. Il n'existe que sous forme d'oxyde de phosphine et non de tautomère hydroxy. Il est apparenté à l'oxyde de diphénylphosphine (C6H5)2P(O)H, et est comme lui un oxyde de phosphine secondaire[3].
Production
[modifier | modifier le code]On obtient de l'oxyde de diméthylphosphine par hydrolyse de la chlorodiméthylphosphine (CH3)2PCl[4] :
Le méthanol CH3OH — mais pas l'éthanol CH3CH2OH — peut être utilisé à la place de l'eau, ce qui donne du chlorure de méthyle CH3Cl comme sous-produit. La chlorodiméthylphosphine étant un produit dangereux, on a cherché d'autres précurseurs pour produire l'oxyde de diméthylphosphine. Une méthode pratique part du diéthylphosphite (CH3CH2O)2P(O)H selon les équations idéalisées suivantes[5] :
- (CH3CH2O)2P(O)H + CH3MgBr ⟶ (CH3CH2O)2P(O)MgBr + CH4 ;
- (CH3CH2O)2P(O)MgBr + 2 CH3MgBr ⟶ (CH3O)2P(O)MgBr + 2 CH3CH2OMgBr ;
- (CH3O)2P(O)MgBr + H2O ⟶ (CH3)2P(O)H + HOMgBr.
Réactions
[modifier | modifier le code]La chloration donne du chlorure de diméthylphosphoryle, tandis que le formaldéhyde HCHO conduit à une hydroxyméthylation :
- (CH3)2P(O)H + HCHO ⟶ (CH3)2P(O)CH2OH.
De nombreux aldéhydes produisent la même réaction.
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Dimethylphosphine oxide », sur echa.europa.eu, ECHA (consulté le ).
- (en) Tanveer Mahamadali Shaikh, Chia-Ming Weng et Fung-E Hong, « Secondary phosphine oxides: Versatile ligands in transition metal-catalyzed cross-coupling reactions », Coordination Chemistry Reviews, vol. 256, nos 9-10, , p. 771-803 (DOI 10.1016/j.ccr.2011.11.007, lire en ligne)
- (de) Hanß‐Jerg Kleiner, « Herstellung und Umsetzungen von Dimethylphosphinoxid », Justus Liebigs Annalen der Chemie, vol. 1974, no 5, , p. 751-764 (DOI 10.1002/jlac.197419740507, lire en ligne)
- (en) Hugh R. Hays, « Reaction of diethyl phosphonate with methyl and ethyl Grignard reagents », The Journal of Organic Chemistry, vol. 33, no 10, , p. 3690-3694 (DOI 10.1021/jo01274a003, lire en ligne)



